Miquel Adrover, Universitat de les Illes Balears y Laura Mariño Pérez, Universitat de les Illes Balears
Seguramente, a muchos de ustedes les resultará difícil concluir la lectura de este artículo sin que se les avive en la mente el recuerdo de un familiar o amigo diabético. Ciertamente, este ejercicio de empatía hubiera sido mucho más inusual a mediados de los años 90, cuando la prevalencia de la diabetes del tipo II (DM2) en nuestro país era únicamente del 3%. Sin embargo, la combinación de unos hábitos cada vez más sedentarios con una dieta poco saludable ha hecho que, actualmente, dicho porcentaje se sitúe en torno al 13.8%.
Este incremento es todavía más acusado a nivel mundial, en especial en países desarrollados. De hecho, son ya 387 millones las personas que han sido diagnosticadas con DM2. Lo peor es que se espera que este número se duplique en el año 2035, convirtiendo a la DM2 en una colosal pandemia.
La cerradura que no funciona
La DM2 aparece a raíz del desarrollo de una resistencia a la acción de la insulina. Esta pequeña proteína actúa como hormona reguladora de la glucólisis. O lo que es lo mismo, como llave que abre las puertas celulares para que la glucosa penetre en ellas y sea transformada en energía.
Así se entiende que si, por alguna razón, la insulina no encaja bien en su cerradura, la glucosa no tiene manera de entrar en las células y se acumula en el torrente sanguíneo (hiperglucemia).
En principio, esta acumulación de glucosa en sangre no debería ser un problema, puesto que constituye la fuente de energía principal de nuestro organismo.
Entonces, ¿por qué los diabéticos tienen problemas de salud? Para entenderlo, debemos adentrarnos en la estructura química de la glucosa.
Su estructura molecular predominante presenta forma de hexágono, con átomos de carbono en cinco de sus vértices y un átomo de oxígeno en el sexto. Esta forma hexagonal es tan estable que normalmente previene la formación de otras estructuras moleculares más reactivas. Una de ellas es la forma lineal de la glucosa, minoritaria (un 0.002% del total) pero muy reactiva frente a proteínas y ADN. Eso, junto a los compuestos carbonílicos y dicarbonílicos formados durante la autooxidación de la forma hexagonal de la glucosa, convierte a la hiperglucemia en tóxica.
Pero, ¿por qué? En esencia porque estos compuestos son capaces de reaccionar con nuestras proteínas, modificando las interacciones que definen sus estructuras y, consecuentemente, sus funciones biológicas. El proceso se conoce como glicación proteica, y es responsable del desarrollo de la retinopatía, la nefropatía o la neuropatía diabética.
Cerebro vulnerable
Recientemente se ha constatado que la glicación de proteínas en las neuronas del cerebro estimula también la aparición de patologías neurodegerativas en diabéticos. Dicha correlación es relativamente reciente y todavía no se conocen los mecanismos que hay detrás. Y claro, sin este conocimiento es imposible desarrollar terapias efectivas que prevengan su aparición.
Decididos a acabar con este vacío, hace unos años decidimos emprender el estudio molecular de cómo la glicación puede causar párkinson. Partíamos de un estudio observacional, realizado en el 2016 sobre casi 2 millones de pacientes, que demostraba que los diabéticos presentan un 38% más de probabilidad de sufrir esta enfermedad neurodegenerativa.
Pero antes, hagamos un inciso. ¿Sabemos por qué se desarrolla párkinson? Para explicarlo debemos viajar dentro de las neuronas de la sustancia negra del cerebro. En ellas encontramos una pequeña proteína que carece de estructura tridimensional, la alfa-sinucleína (aS). Esta molécula participa en el empaquetamiento (la encapsulación vesicular) de la dopamina, un neurotransmisor clave en el cerebro. Pero también en su posterior transmisión entre neuronas. En otras palabras, es esencial para que las neuronas puedan hablar entre ellas.
Si aparecen factores genéticos (mutaciones) o esporádicos (modificaciones químicas) que implican directamente a la aS, puede haber consecuencias. O bien se inhibe su unión a vesículas, o bien acaban depositándose dentro de la célula e induciendo a la muerte neuronal. Ambos procesos implican una disminución de la comunicación interneuronal y la aparición de los síntomas que caracterizan a la enfermedad de Parkinson.
Tras este paréntesis, retomemos de nuevo el análisis de la correlación entre la diabetes y el párkinson. Además de los resultados observacionales ya comentados, se ha demostrado que los agregados de aS aislados de neuronas de pacientes diabéticos que fallecieron a causa del párkinson presentan una elevada densidad de compuestos procedentes de la glicación (AGEs).
Las moléculas que conectan la diabetes y el párkinson
Fue este hecho el que nos despertó un gran número de inquietudes. ¿Se forman estos productos finales de la glicación sobre la proteína en disolución, o bien sobre la proteína ya precipitada (forma insoluble) en el espacio intraneuronal? Si se forman sobre la aS en disolución, ¿pueden hacer que se aglomere y se precipite? ¿Quizás inhiben la interacción entre la aS y las vesículas? ¿Se forman debido al incremento de los productos de la glucólisis intraneuronal, o bien a posteriori, a raíz del estrés carbonílico acontecido durante la muerte neuronal?
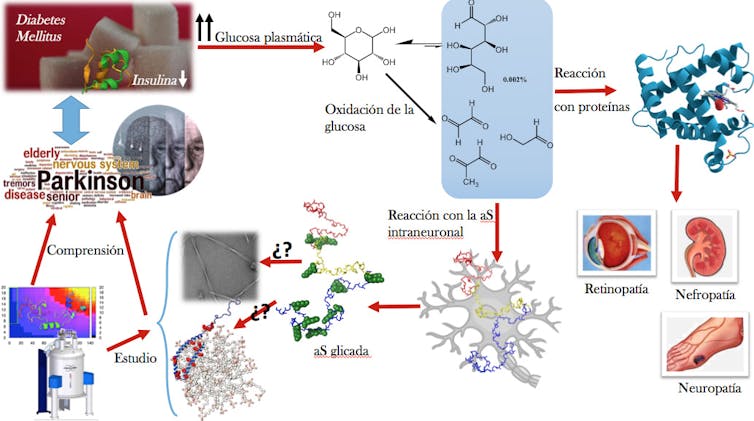
Actualmente, todos los esfuerzos de nuestro grupo de investigación (Reactividad Molecular y Diseño de Fármacos de la UIB) se centran en intentar dar respuesta a estas preguntas. Para ello utilizamos conjuntamente técnicas experimentales y métodos computacionales.
Hasta ahora hemos conseguido describir el efecto de la modificación de las lisinas, uno de los aminoácidos más abundantes en la aS. Usamos la Nε-carboxietillisina (CEL), uno de los AGEs detectados in vivo que altera la conformación de la aS. También hemos demostrado que dificulta la asociación de diferentes moléculas de aS y su posterior precipitación, así como la unión de la aS a vesículas, imposibilitando así su función biológica.
Estos resultados no representan más que la primera piedra que ha de permitir relacionar, desde un punto de vista molecular, la diabetes con la enfermedad de Parkinson. La generación de este conocimiento conducirá al diseño de estrategias terapéuticas para que ese familiar o ese amigo que actualmente padece diabetes, presente un menor riesgo a desarrollar párkinson.
Miquel Adrover, , Universitat de les Illes Balears y Laura Mariño Pérez, Investigador postdoctoral en Biología Estructural, Universitat de les Illes Balears
Este artículo fue publicado originalmente en The Conversation. Lea el original.

 Global
Global
 México
México
 España
España
 Argentina
Argentina
 Colombia
Colombia
 EEUU
EEUU
 Chile
Chile
 Perú
Perú
 Costa Rica
Costa Rica
 Uruguay
Uruguay












